Amigos favoritos de la física del buceo
By Gemma Smith
Para muchos nuevos buceadores, la física y la teoría de las leyes del gas pueden parecer inicialmente un poco secas. No es tan emocionante como meterse en el agua, ¿verdad? En realidad, estas diversas leyes de los gases constituyen uno de los aspectos más interesantes y relacionados de la teoría del buceo. En los últimos siglos, varios físicos han transformado nuestra comprensión del comportamiento de los gases. Esto ha permitido que nuestro deporte de buceo crezca exponencialmente, y se vuelva infinitamente más seguro. Muchas personas inicialmente se resisten ante la idea de tener que «volver a la escuela» para repasar su física de buceo. Sin embargo, lo que pronto descubrirás es que a nivel práctico es mucho más fácil de lo que piensas. Comencemos observando a algunos de nuestros amigos físicos más inspiradores y de vanguardia a lo largo de los años. Aún más importante, veamos cómo sus descubrimientos afectan nuestros cuerpos y equipos en cada inmersión que realizamos.
Ley de Boyle
Nombrada en honor a Robert Boyle (1627-1691), esta ley también puede denominarse a veces la Ley Boyle-Marriotte. Esto es en honor al físico francés Edme Marriotte (1620-1684). Curiosamente, en realidad descubrió esta misma ley del gas en la época en que lo hizo Boyle. Sin embargo, en el mundo del buceo, es más comúnmente conocido simplemente como la «Ley de Boyle»
En su nivel más básico, la Ley de Boyle establece:
A una temperatura constante, el volumen de un gas varía inversamente con la presión. La densidad de un gas varía directamente con la presión.
Ahora eso está muy bien, pero ¿qué significa realmente? Básicamente, se dice que cuando la presión circundante aumenta, el volumen del gas disminuirá. La misma cantidad de gas ocupará menos espacio. Esto depende de que la temperatura se mantenga constante. Por otro lado, a medida que aumenta la presión circundante, también aumentará la densidad del gas. Una vez que entienda estos dos aspectos de la Ley de Boyle, verá que afecta a todos los buceadores, en todo momento, cuando están bajo el agua. Por ejemplo:
- ¿Por qué usas más gas en profundidad que cuando buceas poco profundo?
- ¿Por qué necesita igualar los espacios aéreos, como oidos, máscara y senos nasales en el descenso?
- ¿Por qué tiene que ventilar el aire de su BCD / ala en ascenso para mantener una velocidad lenta y controlada?
- ¿Por qué necesita agregar más aire a su traje seco o ala cuando bucea más profundo para mantener una flotabilidad neutral?
- ¿Por qué la regla más importante en el buceo es nunca, nunca contener la respiración?
Las respuestas a todos estos ejemplos están directamente relacionadas con la Ley de Boyle. Él realmente es el abuelo de la física del buceo, y alguien a quien debemos recordar cada vez que nos sumergimos.
Ley de Dalton
Ahora tengo que admitir que tengo una debilidad por John Dalton (1766-1844). Cuando comencé a practicar el buceo «técnico», su fórmula fue la columna vertebral de mi aprendizaje. La Ley de Dalton es algo que todavía utilizo en cada inmersión que hago, especialmente en las etapas de planificación. Dice:
La presión total ejercida por una mezcla de gases es igual a la suma de las presiones que ejercería cada uno de los gases si solo estuviera presente y ocupada por el volumen total.
A primera vista, esto parece confuso, pero en realidad es muy simple. Todo lo que está diciendo es que a medida que aumenta la presión, también aumentará la presión parcial de todos los gases separados en una mezcla. Así que veamos esto con más detalle.
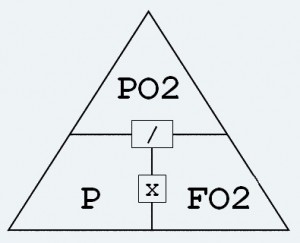
El aire se compone de aproximadamente de 79% de nitrógeno y 21% de oxígeno. En la superficie, a 1 bar de presión, la presión parcial de nitrógeno se igualará a 0.79. La presión parcial de oxígeno será de 0.21. Fácil. Entonces, ¿qué sucede cuando aumenta la presión (como cuando buceamos)? Imagínate bajando a 20m / 66ft. La presión aumenta una atmósfera de presión absoluta (ATA) por cada 10 m descendidos. Eso significa que a 20 m / 66 pies la presión será de 3 bar. Como hemos visto, a medida que aumenta la presión, también aumentará la presión parcial de los diferentes componentes de una mezcla de gases. Entonces, si está respirando aire a 20 m / 66 pies, la presión parcial de nitrógeno sería de 2.37 (0.79 multiplicado por 3). La presión parcial de oxígeno sería 0,63 (0,21 multiplicado por 3). ¡Sencillo! Dalton resolvió todo esto e ideó el ‘Triángulo de Dalton’. Esta fórmula muestra la relación entre la presión parcial, la fracción de oxígeno en una mezcla de gases y la presión ambiental. Esto ha sido en beneficio de cada buceador en el mundo. Permite el cálculo del mejor contenido de oxígeno de una mezcla de gases. Nos permite calcular la profundidad máxima de operación de ciertas mezclas de gases. La misma ley se aplica a la mezcla de trimix, heliox y cualquier otro gas mezclado que pueda usar. Es una fórmula que probablemente utilizará una y otra vez durante el resto de su viaje de buceo.
Ley de Henry
J. William Henry (1774-1836) fue un médico de Inglaterra. A principios del siglo XIX formuló el concepto de «Ley de Henry». Esta ley dice:
La cantidad de un gas dado disuelto en un tipo y volumen dados de líquido es directamente proporcional a la presión parcial de ese gas. Esto está en equilibrio con ese líquido. Todo esto supone que la temperatura se mantiene constante.
En su corazón, esta ley se refiere a dos conceptos simples. La idea de que cuanto mayor sea la presión a la que está sometido, más gas absorberá en sus tejidos. Esto coincide con el hallazgo de que, desde un aspecto de absorción, la temperatura juega un papel importante. Cuanto más caliente esté, menos gas quedará en forma soluble en su cuerpo. Cuanto más frío esté, más gas quedará en la solución en sus tejidos.
Entonces, ¿cómo se relaciona esto con nosotros como buceadores?
En términos simples, lo que esto significa es que cuando la presión ambiental que nos rodea aumenta debido a la profundidad, la presión parcial de oxígeno y nitrógeno en el cuerpo también aumentará. Habrá más moléculas de cada gas disuelto en su sangre y tejidos. Esto tiene un gran impacto en los problemas de descompresión para los buceadores. Todo el gas que absorbemos durante la inmersión, obviamente, necesita gasificación. Es vital que hagamos esto de manera lenta y controlada. Por eso es tan importante un ascenso estable y controlado. También es la razón por la que completar las paradas de descompresión en ciertos perfiles de buceo es tan crítico.
Ley Charles
Por último, pero definitivamente no menos importante, venimos a Charles. Esta ley tiene su nombre en honor a Jacques Alexandre Cesar Charles (1746-1823), quien tomó nota de esta teoría en 1801. La Ley de Charles dice que:
A un volumen constante, la presión de un gas varía directamente con la temperatura absoluta
Esta ley es la más autoexplicativa hasta el momento. Simplemente, cuando el volumen de un llenado de gas permanece constante, la presión aumentará cuando se caliente y disminuirá cuando esté frío. La Ley de Charle explica por qué, si llenamos nuestras botellas en un día caluroso y luego nos sumergimos en agua fría, nuestra presión inicial disminuirá. Por ejemplo, es una temperatura del aire de 15 grados centígrados en el exterior, y usted va a llenar sus botellas. Una botella de 11 litros llena a 200 bar significa que tiene 2200 litros de gas disponibles. El agua en la que se está buceando es de 8 grados. ¡Cuando verifica su presión inicial al comienzo de su inmersión, verá que tiene menos de lo esperado! Esta es la Ley de Charle en acción. Esta es la razón por la cual es importante no dejar una botella recién llenada en el maletero de un automóvil caliente. La presión solo aumentará aún más, y podría dañarse. Esta teoría también explica por qué algunas estaciones de carga de gas en los centros de buceo colocan las botellas en agua fría antes del llenado. Esto es para evitar que las botellas se sobrecalienten.
Originalmente, ninguno de estos conceptos formulados se consideró para una audiencia de buceo. Eran simplemente investigaciones sobre la naturaleza y el comportamiento de los gases. Sin embargo, estos diversos pioneros científicos han resultado ser algunos de los amigos físicos favoritos del buceo. Es a través del conocimiento y la comprensión práctica de estas diversas Leyes de la física que nosotros, como buceadores, podemos ayudarnos a mantenernos seguros, sin importar el tipo de buceo que estemos realizando.










Dejar una Respuesta
¿Quieres unirte a la discusión?¡Siéntete libre de contribuir!